A estas alturas ya sabemos de sobra que el
Orden himenóptera lo subdividimos en dos grupos que son
Symphita y Apocrita y que ha estos últimos los subdividimos a su vez tradicionalmente en dos grupos sin valor taxonómico que son
Aculeata y Parasítica.
Aculeata se caracteriza porque en ellos el ovopositor de la hembra se transforma en aguijón y se subdivide en tres superfamilias:
Apoidea, Chrysidoidea y Vespoidea.
La Superfamilia vespoidea está compuesta por trece familias vivas más una extinta:
- Familia Armaniidae - Extinta
Los formícidos (familia Formicidae), conocidos comúnmente como hormigas, evolucionaron de antepasados similares a una avispa a mediados del Cretáceo (entre 110 y 130 millones de años) diversificándose tras la expansión de las plantas con flor por el mundo. Hay cerca de 14 000 especies descritas, aunque se estima que pueden ser más de 22 000. Posiblemente haya entre mil billones (1015) y diez mil billones (1016) de hormigas viviendo sobre la Tierra.
La palabra «hormiga» aparece por primera vez en el siglo XIV y deriva de la palabra latina formīca, que significa hormiga. Sin embargo, la rama de la entomología que estudia las hormigas se denomina mirmecología.
Las hormigas habitan en todos los continentes excepto la Antártida y algunas grandes islas, como Groenlandia, Islandia y partes de Polinesia. Las islas hawaianas también carecen de especies de hormigas nativas.
Las hormigas ocupan una gran variedad de nichos ecológicos y son capaces de explotar una amplia gama de recursos alimenticios actuando como herbívoras directas o indirectas, depredadoras y carroñeras. La mayor parte de las especies son omnívoras generalistas pero algunas se alimentan de forma especializada.
Los formícidos son insectos holometábolos (desarrollo mediante metamorfosis completa). La larva permanece prácticamente inmóvil y es alimentada mediante trofolaxis (una hormiga regurgita la comida líquida almacenada en su buche) y cuidada por las obreras. Las larvas también pueden recibir alimentos sólidos, como por ejemplo huevos tróficos (no fecundados), trozos de presas, semillas traídas por obreras recolectoras o, en el caso de algunas especies, incluso pueden ser transportadas directamente hasta una presa capturada.Las hormigas tienen unas características morfológicas distintas de otros insectos, como las antenas en codo, glándulas metapleurales y una fuerte constricción de su segundo segmento abdominal en un peciolo en forma de nodo. La cabeza, mesosoma (el tórax más el primer segmento abdominal, fusionado a éste) y metasoma o gáster (el abdomen menos los segmentos abdominales del peciolo) son sus tres segmentos corporales claramente diferenciados.
Imagen tomada de Wikipedia
El peciolo forma una cintura estrecha entre su mesosoma y el gáster. El peciolo puede estar formado por uno o dos nodos (solo el segundo, o el segundo y tercer segmento abdominal).
La cabeza de una hormiga contiene dos ojos compuestos, tres pequeños ocelos y dos antenas, dos fuertes mandíbulas que usan para transportar alimentos, manipular objetos, construir nidos y para defenderse y algunas especies, una cámara intrabucal donde almacenan alimento, para después pasárselo a otras hormigas o a las larvas.
Sus seis patas están ancladas al mesosoma (tórax). Una garra ganchuda situada al final de cada pata ayuda al animal a escalar y a engancharse a varios tipos de superficies.
Solo las hormigas reproductoras, reinas y machos tienen alas; las reinas las pierden después del vuelo nupcial, dejando unas marcas visibles que son un rasgo distintivo de las reinas. Sin embargo, en algunas especies las reinas y los machos tampoco tienen alas.
El metasoma (abdomen) de las hormigas alberga órganos internos importantes, incluidos los del sistema reproductor, respiratorio (tráquea) y excretor. Las obreras de muchas especies tienen el ovipositor modificado en un aguijón que usan para someter a las presas y defender sus nidos.
La mayoría de las especies de hormigas son univoltinas, y producen una sola nueva generación cada año.Las hormigas manifiestan haplodiploidía, es decir, que la vida de una hormiga comienza a partir de un huevo; si está fertilizado, nacerá una hembra (diploide); si no, un macho (haploide). Se han descrito una gran variedad de estrategias reproductivas en distintas especies de hormigas. Se sabe que las hembras de algunas especies tienen la capacidad de reproducirse asexuadamente por partenogénesis telitoquia y una especie, Mycocepurus smithii, está compuesta solo por hembras.
Las hormigas se comunican entre ellas por medio de feromonas. Algunas especies incluso usan «feromonas de propaganda» para confundir a las especies enemigas y hacerlas luchar entre sí. Las feromonas son producidas por una gran variedad de estructuras, como la glándula de Dufour, las glándulas venenosas y las del intestino posterior, el pigidio, el recto, el esternón y la tibia posterior. Las feromonas también pueden ser intercambiadas cuando se mezclan con la comida y son traspasadas por trofalaxia, acción que permite transmitir información dentro de la colonia. Esto también les permite determinar a qué grupo de trabajo pertenecen los otros miembros de la colonia. En las especies con castas de reinas, las obreras empiezan a criar nuevas reinas en la colonia cuando la reina dominante deja de producir una feromona específica.
Las hormigas identifican a sus compañeras de colonia por su olor, que proviene de las secreciones de hidrocarburos que cubren su exoesqueleto. Si una hormiga se separa de su colonia original, acaba por perder el olor de su colonia. Cualquier hormiga que entre en un hormiguero sin tener un olor coincidente será atacada.
Algunas hormigas producen sonidos por medio de estridulación (haciendo rozar dos partes del cuerpo), utilizando los segmentos del gáster y las mandíbulas. Los sonidos pueden servir para comunicarse con miembros de la colonia o con otras especies.
Las hormigas atacan y se defienden mordiendo y en algunas especies picando, además, a menudo inyectan o rocían productos químicos como el ácido fórmico.
Muchas especies construyen hormigueros complejos, pero otras son nómadas y no crean estructuras permanentes. Pueden construir colonias subterráneas o construirlas en árboles y otras estructuras naturales o artificiales. Estos nidos pueden encontrarse bajo tierra, bajo piedras o troncos, en el interior de troncos, tallos huecos o incluso bellotas. Los materiales que utilizan para construir el hormiguero generalmente incluyen tierra y materia vegetal.
Las hormigas tienen relaciones simbióticas con una gran variedad de especies, como otras hormigas, insectos, plantas y hongos. Son la presa de muchos animales e incluso algunos hongos. Algunas especies de artrópodos pasan parte de su vida en hormigueros, bien alimentándose de las hormigas, sus larvas, sus huevos y sus reservas de alimentos, o bien escondiéndose de sus predadores. Estos inquilinos pueden asemejarse mucho en su aspecto a las hormigas. La naturaleza de esta imitación de las hormigas (denominada «mirmecomorfia») varía, y en algunos casos incluye el mimetismo batesiano, en el que el mimetismo reduce el riesgo de depredación. Otros muestran mimetismo wasmaniano, un tipo de mimetismo observado únicamente en inquilinos.
Subfamilias
- Amblyoponinae (incl. Apomyrminae)
- Myrmeciinae (incl. Nothomyrmeciinae)
Una lista de la mimercofauna de la Península Ibérica realizada en Agosto del 2001 recoge un totalde 239 especies entre las que se encuentran: 10 Dolichoderinae, 83 Formicinae, 5 Leptanillinae, 131Myrmicinae y 10 Ponerinae.
Dolichoderinae
Bothriomyrmex hispanicus Santschi, 1922
Bothriomyrmex gibbus Soudek, 1925
Bothriomyrmex saundersi Santschi, 1922
Dolichoderus quadripunctatus (Linnaeus, 1771)
Linepithema humile (Mayr, 1868)
Tapinoma ambiguum Emery, 1925
Tapinoma erraticum (Latreille, 1798)
Tapinoma nigerrimum (Nylander, 1856)
Tapinoma pygmaeum (Dufour, 1857)
Tapinoma simrothi Krausse, 1911
Formicinae
Camponotus aethiops (Latreille, 1798)
Camponotus amaurus Espadaler, 1997
Camponotus barbaricus Emery, 1905
Camponotus cruentatus (Latreille, 1802)
Camponotus fallax (Nylander, 1856)
Camponotus figaro (Collingwood & Yarrow, 1969)
Camponotus foreli Emery, 1881
Camponotus gestroi Emery, 1878
Camponotus haroi Espadaler, 1997
Camponotus herculeanus (Linnaeus, 1758)
Camponotus lateralis (Olivier, 1792)
Camponotus ligniperdus (Latreille, 1802)
Camponotus micans (Nylander, 1856)
Camponotus piceus (Leach, 1825)
Camponotus pilicornis (Roger, 1859)
Camponotus sicheli Mayr, 1866
Camponotus sylvaticus (Olivier, 1792)
Camponotus truncatus (Spinola, 1808)
Camponotus universitatis Forel, 1890
Camponotus vagus (Scopoli, 1763)
Cataglyphis douwesi De Haro & Collingwood, 2000
Cataglyphis floricola Tinaut, 1993
Cataglyphis hispanicus (Emery, 1906)
Cataglyphis humeya Tinaut, 1991
Cataglyphis ibericus (Emery, 1906)
Cataglyphis piliscapus (Forel, 1901)
Cataglyphis rosenhaueri Santschi, 1925
Cataglyphis velox Santschi, 1929
Formica candida F. Smith, 1878
Formica cunicularia Latreille, 1798
Formica decipiens Bondroit, 1918
Formica dusmeti Emery, 1909
Formica exsecta Nylander, 1846
Formica foreli Bondroit, 1918
Formica frontalis Santschi, 1919
Formica fusca Linnaeus, 1758
Formica gagates Latreille, 1798
Formica gerardi Bondroit 1917
Formica lemani Bondroit, 1917
Formica lugubris Zetterstedt, 1838
Formica polyctena Förster, 1850
Formica pratensis Retzius, 1783
Formica pressilabris Nylander, 1846
Formica rufa Linnaeus, 1761
Formica rufibarbis Fabricius, 1793
Formica sanguinea Latreille, 1798
Formica selysi Bondroit, 1918
Formica subrufa Roger, 1859
Lasius alienus (Schenck, 1852)
Lasius bicornis (Förster, 1850)
Lasius brunneus (Latreille, 1798)
Lasius carniolicus Mayr, 1861
Lasius cinereus Seifert, 1992
Lasius citrinus Emery, 1922
Lasius distinguendus (Emery, 1916)
Lasius emarginatus (Olivier, 1792)
Lasius flavus (Fabricius, 1782)
Lasius fuliginosus (Latreille, 1798)
Lasius grandis Forel, 1909
Lasius lasioides (Emery, 1869)
Lasius meridionalis (Bondroit, 1920)
Lasius mixtus (Nylander, 1846)
Lasius myops Forel, 1894
Lasius neglectus Van Loon, Boomsma & András
Lasius niger (Linnaeus, 1758)
Lasius piliferus Seifert, 1992
Lasius platythorax Seifert, 1991
Lasius rabaudi (Bondroit, 1917)
Lasius sabularum (Bondroit, 1918)
Lasius umbratus (Nylander, 1846)
Lepisiota nigra (Dalla Torre, 1893)
Paratrechina flavipes (F. Smith, 1874)
Paratrechina jaegerskioeldi (Mayr, 1904)
Paratrechina longicornis (Latreille, 1802)
Plagiolepis grassei Le Masne, 1956
Plagiolepis pygmaea (Latreille, 1798)
Plagiolepis schmitzii Forel, 1895
Plagiolepis xene Stärcke, 1936
Polyergus rufescens (Latreille, 1798)
Proformica ferreri Bondroit, 1918
Proformica longiseta Collingwood, 1978
Proformica nasuta (Nylander, 1856)
Rossomyrmex minuchae Tinaut, 1981
Leptanillinae
Leptanilla charonea López, Martínez & Barandica,
Leptanilla ortunoi López, Martínez & Barandica,
Leptanilla plutonia López, Martínez & Barandica,
Leptanilla revelierii Emery, 1870
Leptanilla zaballosi López, Martínez & Barandica,
Myrmicinae
Anergates atratulus (Schenck, 1852)
Aphaenogaster cardenai Espadaler, 1981
Aphaenogaster dulcineae Emery, 1924
Aphaenogaster gibbosa (Latreille, 1798)
Aphaenogaster iberica Emery, 1908
Aphaenogaster senilis Mayr, 1853
Aphaenogaster splendida (Roger, 1859)
Aphaenogaster striativentris Forel, 1895
Aphaenogaster subterranea (Latreille, 1798)
Cardiocondyla batesii Forel, 1894
Cardiocondyla elegans Emery, 1869
Cardiocondyla mauritanica Forel, 1890
Chalepoxenus kutteri Cagniant, 1973
Chalepoxenus muellerianus (Finzi, 1922)
Crematogaster auberti Emery, 1869
Crematogaster fuentei Menozzi, 1922
Crematogaster laestrygon Emery, 1869
Crematogaster scutellaris (Olivier, 1792)
Crematogaster sordidula (Nylander, 1849)
Epimyrma bernardi Espadaler, 1982
Epimyrma kraussei Emery, 1915
Epimyrma ravouxi (André, 1896)
Formicoxenus nitidulus (Nylander, 1846)
Goniomma baeticum Reyes & Rodríguez, 1987
Goniomma blanci (André, 1881)
Goniomma collingwoodi Espadaler, 1997
Goniomma compressisquama Tinaut,
Goniomma decipiens Espadaler, 1997
Goniomma hispanicum (André, 1883)
Goniomma kugleri Espadaler, 1986
Harpagoxenus sublaevis (Nylander, 1849)
Leptothorax acervorum (Fabricius, 1793)
Leptothorax affinis Mayr, 1855
Leptothorax albipennis (Curtis, 1854)
Leptothorax algiricus Forel, 1894
Leptothorax angustulus (Nylander, 1856)
Leptothorax baeticus Emery, 1924
Leptothorax blascoi Espadaler, 1997
Leptothorax caesari Espadaler, 1997
Leptothorax cagnianti Tinaut, 1983
Leptothorax cervantesi Santschi, 1919
Leptothorax clypeatus (Mayr, 1853)
Leptothorax corticalis (Schenck, 1852)
Leptothorax crepuscularis Tinaut, 1994
Leptothorax cristinae Espadaler, 1997
Leptothorax flavispinus s.l. André, 1883
Leptothorax formosus Santschi, 1909
Leptothorax gredleri Mayr, 1855
Leptothorax gredosi Espadaler & Collingwood, 1982
Leptothorax grouvellei Bondroit, 1918
Leptothorax ibericus Menozzi, 1922
Leptothorax interruptus (Schenck, 1852)
Leptothorax kraussei Emery, 1916
Leptothorax lichtensteini Bondroit, 1918
Leptothorax longispinosus Roger, 1863
Leptothorax muscorum (Nylander, 1846)
Leptothorax nadigi Kutter, 1925
Leptothorax niger Forel, 1894
Leptothorax nigriceps Mayr, 1855
Leptothorax nylanderi (Förster, 1850)
Leptothorax pardoi Tinaut, 1987
Leptothorax parvulus (Schenck, 1852)
Leptothorax platycephalus Espadaler, 1997
Leptothorax rabaudi Bondroit, 1918
Leptothorax racovitzai Bondroit, 1918
Leptothorax recedens (Nylander, 1856)
Leptothorax schaufussi (Forel, 1879)
Leptothorax specularis Emery, 1916
Leptothorax subcingulatus Emery, 1924
Leptothorax tristis Bondroit, 1918
Leptothorax tuberum (Fabricius, 1775)
Leptothorax tyndalei Forel, 1909
Leptothorax unifasciatus (Latreille, 1798)
Leptothorax universitatis Espadaler, 1997
Messor barbarus (Linnaeus, 1767)
Messor bouvieri Bondroit, 1918
Messor capitatus (Latreille, 1798)
Messor celiae Reyes, 1985
Messor hispanicus Santschi, 1919
Messor lobicornis Forel, 1894
Messor lusitanicus Tinaut, 1985
Messor marocanus Santschi, 1927
Messor structor (Latreille, 1798)
Messor timidus Espadaler, 1997
Monomorium algiricum (Bernard, 1955)
Monomorium andrei Saunders, 1890
Monomorium carbonarium (F. Smith, 1858)
Monomorium pharaonis (Linnaeus, 1758)
Monomorium salomonis (Linnaeus, 1758)
Monomorium subopacum (F. Smith, 1858)
Myrmecina graminicola (Latreille, 1802)
Myrmica aloba Forel, 1909
Myrmica lemasnei Bernard, 1967
Myrmica lobicornis Nylander, 1846
Myrmica rubra (Linnaeus, 1758)
Myrmica ruginodis Nylander, 1846
Myrmica sabuleti Meinert, 1861
Myrmica scabrinodis Nylander, 1846
Myrmica schencki Viereck, 1903
Myrmica specioides Bondroit, 1918
Myrmica sulcinodis Nylander, 1846
Myrmica vandeli Bondroit, 1920
Myrmica wesmaeli Bondroit, 1918
Oxyopomyrmex santschii Forel, 1904
Oxyopomyrmex saulcyi Emery, 1889
Pheidole pallidula (Nylander, 1849)
Pheidole teneriffana Forel, 1893
Pyramica argiola (Emery, 1869)
Pyramica baudueri (Emery, 1875)
Pyramica membranifera (Emery, 1869)
Pyramica tenuipilis (Emery, 1915)
Solenopsis fairchildi Wheeler, 1926
Solenopsis fugax (Latreille, 1798)
Solenopsis latro Forel, 1894
Solenopsis lusitanica Emery, 1915
Solenopsis monticola Bernard, 1950
Solenopsis nicaeensis Bernard, 1950
Solenopsis oraniensis Forel, 1894
Solenopsis orbula Emery, 1875
Solenopsis robusta Bernard, 1950
Stenamma debile (Förster, 1850)
Stenamma striatulum Emery, 1894
Strongylognathus caeciliae Forel, 1897
Strongylognathus huberi Forel, 1874
Strongylognathus testaceus (Schenck, 1852)
Teleutomyrmex kutteri Tinaut, 1990
Tetramorium caespitum (Linnaeus, 1758)
Tetramorium impurum (Förster, 1850)
Tetramorium meridionale Emery, 1870
Tetramorium ruginode Stitz, 1917
Tetramorium semilaeve André, 1883
Ponerinae
Amblyopone emeryi (Saunders, 1890)
Amblyopone gaetulica Baroni Urbani, 1978
Anochetus ghilianii (Spinola, 1851)
Cryptopone ochracea (Mayr, 1855)
Hypopone abeillei (André, 1881)
Hypoponera eduardi (Forel, 1894)
Hypoponera punctatissima (Roger, 1859)
Hypoponera ragusai (Emery, 1894)
Ponera coarctata (Latreille, 1802)
Proceratium melinum (Roger, 1860)
Los formicinos (subfamilia Formicinae) son hormigas sin aguijón y sin el postpecíolo. Sus más de 3300 especies se distribuyen por todo el planeta, excepto la Antártida.
Se reconocen las siguientes tribus:
- Formicini Latreille, 1809
- Gesomyrmecini Ashmead, 1905
- Gigantiopini Ashmead, 1905
- Myrmelachistini Forel, 1912
- Myrmoteratini Emery, 1895
- Plagiolepidini Forel, 1886
- Santschiellini Forel, 1917
quedando en incertae sedis las siguietes especies extintas:
†Camponotites Steinbach, 1967
†Curtipalpulus Hong, 2002
†Drymomyrmex Wheeler, W.M., 1915
†Eoleptocerites Hong, 2002
†Eurytarsites Hong, 2002
†Fushuniformica Hong, 2002
†Heeridris Dlussky & Putyatina, 2014
†Huaxiaformica Hong, 2002
†Imhoffia Heer, 1849
†Kyromyrma Grimaldi & Agosti, 2000
†Leptogasteritus Hong, 2002
†Leucotaphus Donisthorpe, 1920
†Liaoformica Hong, 2002
†Longiformica Hong, 2002
†Magnogasterites Hong, 2002
†Orbicapitia Hong, 2002
†Ovalicapito Hong, 2002
†Ovaligastrula Hong, 2002
†Protrechina Wilson, 1985
†Sinoformica Hong, 2002
†Sinotenuicapito Hong, 2002
†Wilsonia Hong, 2002
Clave para los géneros de la subfamilia formicinae (obreras)
1:
- Antenas con un máximo de 11 segmentos......Anoplolepis, Acropyga, Plagiolepis, Myrmelachista,
Brachymyrmex (2)
- Antenas con 12 segmentos...... Gigantiops, Dendromyrmex, Colobopsis, Camponotus, Polyergus, Acanthomyops, Myrmecocystus, Formica, Lasius, Lasiophanes, Prenolepis, Paratrechina (6)
2:
-Cuerpo alargado; dorso mesosomal usualmente sin pelos erectos; escapo alargado y 1,5 - 2 veces más largo que la cabeza......
Anoplolepis
-Cuerpo robusto y dorso mesosomal usualmente con pelos erectos conspicuos; escapo menos a un poco más largo que la cabeza...... Acropyga, Plagiolepis, Myrmelachista, Brachymyrmex (3)
3:
- Mandíbulas esbeltas, casi rectas y con el borde masticador muy oblicuo, y tridentado; ojos atrofiados y anterolaterales......
Acropyga
-Mandíbulas robustas y el borde masticador con 4 o más dientes; ojos más grandes.......Plagiolepis, Myrmelachista, Brachymyrmex (4)
4:
- Antenas de 11 segmentos; el perfil del mesosoma en vista lateral es continuo y carece de suturas o surcos notables......
Plagiolepis
- Antenas de 9 o 10 segmentos; el perfil mesosomal con una o dos suturas
notables.......Myrmelachista, Brachymyrmex (5)
5:
- Antenas apicalmente forman un mazo; el nódulo peciolar es erecto y está expuesto; sutura mesometanotal amplia y profunda; arbóreas.......
Myrmelachista
- Antenas esbeltas, sin mazo; nódulo peciolar inclinado y escondido debajo del gaster; frecuentes sobre el suelo......
Brachymyrmex
6:
- Ojos grandes, ocupando casi todo el lado de la cabeza......
Gigantiops
- Ojos no ocupan más que la mitad de cada lado cefálico...... Dendromyrmex, Colobopsis, Camponotus, Polyergus, Acanthomyops, Myrmecocystus, Formica, Lasius, Lasiophanes, Prenolepis, Paratrechina (7)
7:
- En vista lateral el perfil superior del mesosoma es continuo y parejamente convexo; el propodeo no está hundido más del promesonoto y carece de una sutura entre el mesonoto y el propodeo o ésta tiene poco desarrollo......Dendromyrmex, Colobopsis, Camponotus (8)
- El perfil superior del mesosoma es discontinuo y no parejamente convexo; el propodeo usualmente está hundido e inferior al nivel del promesonoto, la sutura entre el mesonoto y propodeo siempre está presente y usualmente es profunda.......Polyergus, Acanthomyops, Myrmecocystus, Formica, Lasius, Lasiophanes, Prenolepis, Paratrechina (10)
8:
- Obreras monomórficas casi siempre carece de surco metanotal; los ojos son prominentes y esferoides......
Dendromyrmex
- Obreras polimórficas la sutura metanotal usualmente presente; ojos no prominentes y esferoidales......Colobopsis, Camponotus (9)
9:
- La cabeza de las obreras mayores son anteriormente truncadas, con los márgenes de la zona truncada bien definidos; mandíbulas de los soldados con apenas 3 dientes apicales......
Colobopsis
- Cabeza de obreras mayores casi nunca están truncadas, y en tal caso, entonces los márgenes son redondeados; las mandíbulas con lodo el margen masticador denticulado.......
Camponotus
10:
- Mandíbulas falcadas y sin dientes; palpos maxilares de 4 segmentos; zonas altas (México).......
Polyergus
- Mandíbulas triangulares y con dientes; palpos maxilares con 3 ó 6 segmentos.......Acanthomyops, Myrmecocystus, Formica, Lasius, Lasiophanes, Prenolepis, Paratrechina (11)
11:
- Palpos maxilares cortos, de 3 segmentos; zonas altas (México)......
Acanthomyops
- Palpos maxilares largos, de 6 segmentos...... Myrmecocystus, Formica, Lasius, Lasiophanes, Prenolepis, Paratrechina (12)
12:
- Palpos maxilares más largos que la cabeza (excluyendo las mandíbulas), sus tercero y cuarto segmentos son cada uno más largos que los dos segementos apicales juntos; psamóforo presente, a veces poco desarrollado; zonas secas (México).......
Myrmecocystus
- Palpos maxilares no son más largos que la cabeza, ni sus tercer y cuarto son tan largos; carencia total de psamóforo.......Formica, Lasius, Lasiophanes, Prenolepis, Paratrechina (13)
13:
- Las carenas frontales forman pequeñas crestas con un ápice angular; el clipeo presenta una carena longitudinal anteromediana; zonas altas (México).......
Formica
- Carenas frontales tienen poco o ningún desarrollo, si están presentes, cada una tiene su ápice redondeado; clipeo sin carena median....... Lasius, Lasiophanes, Prenolepis, Paratrechina (14)
14:
- Mandíbulas con 7 o más dientes; el escapo antenal sobrepasa el borde del vértice no más que 2-3 veces el máximo diámetro del escapo, usualmente menos.......Lasius, Lasiophanes (15)
- Mandíbulas con 5-6 dientes; el escapo frecuentemente sobrepasa el borde del vértice por 4-5 veces su máximo diámetro....... Prenolepis, Paratrechina (16)
15:
- En vista lateral el perfil declinante propodeal es bastante más largo que el perfil dorsal y en su unión forman un ángulo redondeado; fosetas antenales usualmente separadas del clipeo por lo menos por un tercio de su diámetro; zonas altas (México).......
Lasius
- En vista lateral el perfil declinante propodeal es más o menos igual en longitud que el perfil dorsal, los dos perfiles se unen a través de una convexidad continua; fosetas antenales casi siempre tocan el margen posterior del clipeo, o está separado por menos de un cuarto de su diámetro (Chile y Argentina)......
Lasiophanes
16:
- En vista dorsal el mesosoma se estrecha notablemente a nivel del mesonoto; pilosidad del cuerpo no es notablemente gruesa o setiforme, usualmente delgada, color dorado o castaño; zonas altas (Caribe)......
Prenolepis
- En vista dorsal el mesonoto no se estrecha; pilosidad usualmente es gruesa, setiforme y de color casta
ño......
Paratrechina
La tribu Camponotini Forel, 1878 incluye los siguientes géneros:
- Opisthopsis Dalla Torre, 1893
- Overbeckia Viehmeyer, 1916
- †Chimaeromyrma Dlussky, 1988
- †Pseudocamponotus Carpenter, 1930
Camponotus Mayr, 1861
El término Camponotus deriva del griego "kampylos" que significa doblado y "noton" que significa dorso.
Y es que Camponotus es un género de hormigas ecológicamente diverso distribuido en todas las regiones del mundo (aunque hay mayor cantidad de especies en la región Neotropical, en especial en Norteamérica) que se caracteriza porque si se observa de lado a los individuos a él pertenecientes se puede apreciar que el tórax tiene forma de arco convexo. Los rasgos más característicos de este género son la inserción de las antenas alejadas de la base del clípeo y la ausencia de glándula metapleural sobre la coxa trasera (excepto en dos especies de la zona Indo-Australiana). Las obreras son relativamente grandes, de color por lo general negro, con tintes amarronados, muchas veces con partes marrones, rojizas o casi doradas; suelen tener la cabeza grande y el tórax pequeño y no poseen alas. Las reproductivas en cambio suelen ser completamente negras, suelen tener la cabeza pequeña y el tórax grande y las alas son de color transparente o amarronado siendo las de adelante más grandes que las de atrás. Los huevos son de color crema y de forma ovalada. Las larvas son apodas. Las pupas tienen aspecto de cocón firme de color tostado sedoso.
Estas hormigas viven en colonias en las que hay:
•
Reinas: Hembras reproductivas. Tuvieron alas pero ya fueron fecundadas y se las arrancaron para formar su propia colonia, son las únicas que se reproducen dentro de la colonia una vez establecida, su única función es la de poner huevos y ser alimentadas por las obreras con las que se intercambian hormonas por trofalaxis.
•
Princesas: Hembras aladas con potencial para reproducirse pero aún no fecundadas, nacidas en la colonia.
•
Zánganos: Machos alados bastante más pequeños que las hembras cuya única función es la de fecundar a las hembras aladas durante el vuelo nupcial. Tras ello morirán fuera del nido.
•
Obreras: Hembras estériles nacidas en la colonia que representan la mayor cantidad de individuos y están distribuidas en castas de diferentes tamaños.
•
Soldados: Machos estériles que se encargan de la defensa de la colonia; dependiendo de su tamaño pueden ser "generales"(gran tamaño o expertos soldados) y soldados "rasos" (novatos).
Las princesas y los zánganos salen hacia el vuelo nupcial normalmente a principios de verano, en un día diáfano y sin viento. Durante el vuelo nupcial ocurre la cópula, tras lo cual aterrizan en tierra. Los machos mueren poco después a la intemperie. Las hembras, que fueron fecundadas de por vida, se arrancan las alas y buscan un lugar donde hacer su nido. Según las especies, pueden hacer su nido dentro de la madera o bajo el suelo. Tras nidificar ponen sus primeros huevos, que serán atendidos por la misma reina hasta que muden a los estadios de larva, pupa y finalmente obreras. Las primeras obreras de la colonia son sumamente pequeñas y cuando salen por primera vez del nido buscan alimento para alimentarse a sí mismas, y por trofolaxis a la reina y a los nuevos estadios juveniles. También estas primeras obreras excavan las primeras galerías del nido y atienden a los juveniles de la segunda generación. Desde este momento, la reina solo se ocupará de poner huevos, actividad de la que se ocupará el resto de su vida. Las obreras nacidas posteriormente son de mayor tamaño. Unos años después, si no hay estrés por falta de alimento, la colonia produce sus primeras aladas machos y hembras, constituyéndose en los zánganos y las princesas que darán origen a la siguiente generación de colonias.
La mayoría son especies preferentemente arbóreas que se suelen alimentar de las secreciones azucaradas de los áfidos, si bien un grupo tan amplio como este (cerca de 1.000 especies, el mayor de Formicidae) da cabida a todo tipo de comportamientos. El tamaño de las colonias varía también entre 200 (confusus) y más de 15.000 individuos (herculeanus).
Las asociaciones de estas especies con áfidos son muy frecuentes, si bien se alimentan también de otros artrópodos.
La división en subgéneros, si bien no tiene validez taxonómica, si adquiere cierta importancia en este género, ya que debido a la gran cantidad de especies, incluso si tenemos en cuenta solo la zona mediterránea (más de 120 hasta el momento), no es infrecuente que se adscriba cada especie a uno u otro subgénero en las publicaciones taxonómicas.
Los subgéneros presentes en la península Ibérica son cinco:
- Subg. Camponotus s. str. (o grupo herculeanus): Hormigas grandes, robustas y en general lignícolas. Mándibulas de 4-5 dientes (raramente 6), clípeo sin arista ni lóbulo. Dorso del mesosoma convexo, con el declive posterior abrupto.
- Subg. Colobopsis (o grupo truncatus): Dimorfismo muy marcado, con las major y las reinas presentando una cabeza muy característica, con el clípeo y las mándíbulas modificadas de modo que forman una sección casi circular en un ángulo con el resto de la cabeza que emplean para sellar las entradas a los nidos. El mesosoma de las minor presenta también una forma muy característica, con el propodeo ligeramente indentado.
- Subg. Myrmentoma (o grupo lateralis): Talla mediana, con las mandíbulas con 5-6 dientes. Propodeo cúbico, grande, de bordes marcados, formando en general un ángulo entre las caras dorsal y posterior. Presentan una sutura claramente marcada entre mesonoto y propodeo.
- Subg. Myrmosericus (o grupo cruentatus): Mandíbulas de 7-8 dientes. Clípeo con arista y lóbulo marcados. Cabeza de las minor con un borde posterior más o menos marcado. Aspecto general mate, debido a una puntuación densa sobre el tegumento. Muy pubescentes, especialmente sobre el gastro, que les da un cierto aspecto aterciopelado.
- Subg. Tanaemyrmex (o grupo maculatus): Mandíbulas de 7-8 dientes. Clípeo con arista y lóbulo marcados. Cabeza de las minor con un borde posterior más o menos marcado. Aspecto general brillante en la mayoría de los casos, poco pubescente en el gastro.
Este género presenta todavía varios problemas por resolver en la Península Ibérica. Podemos considerar que las especies presentes son las siguientes, agrupadas por subgéneros:
En la Península Ibérica se pueden distinguir tres grupos de especies. Dos especies del grupo s. str. (herculeanus y ligniperdus) son especies paleárticas de alta montaña, restringidas a cotas elevadas de Pirineos, Sistema Central o Cantabria. Varias especies están distribuidas por toda la Península Ibérica (aethiops, cruentatus, fallax, lateralis, piceus) y el resto evitan las zonas más frías, limitando su ditribución a la mitad Sur de la Península o bien a la zona Mediterránea.
En cuanto a su distribución global, se pueden agrupar en:
* Ausentes del Norte de África o con citas dudosas
Clave para el género Camponotus
1:
-Aristas frontales rectas. Presentan una casta especializada con la cabeza fuertemente truncada vista de perfil, casi a 90 grados. Longitud de estas obreras, entre 4 y 6 mm. Parte posterior del propodeo no cóncava. Peciolo emarginado en la parte superior......
Camponotus truncatus
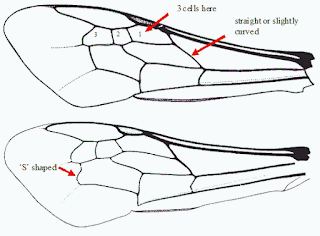
-Aristas frontales en forma de "S". Sin casta especializada, cabeza no truncada.....2
2:
-Sutura mesopropodeal marcada, de modo que en vista de perfil propodeo y mesonoto están separados por una profunda incisión. Además presentan clípeo emarginado. Subgénero Myrmentoma.....8
-Sutura mesopropodeal difusa, de modo que propodeo y mesonoto forman una linea contínua vistos de perfil. Clípeo emarginado o no. Si presentan una sutura mesopropodeal marcada, no es tan acusada como en las anteriores y además el clípeo no está emarginado......3
3:
-Clipeo provisto de una arista media claramente distinguible, Además de un lóbulo medio más o menos rectangular. Mandíbulas de 5 o 6 dientes. Propodeo estrecho, más o menos comprimido......4
-Clípeo sin arista media ni lóbulo medio claramente definidos. Mandíbulas de 6-7 dientes. Propodeo más o menos redondeado. Subgénero Camponotus s. str......5
4:
-Gastro brillante. Cuerpo poco peludo, brillante, al menos sobre el torax. Subgénero Tanaemyrmex.....11
-Gastro mate. Todo el cuerpo con un pubescencia tupida. Mate. Myrmosericus .....17
5:
-Clípeo con una profunda melladura en su parte central. Arborícola. Camponotus fallax
-Clípeo sin melladura en su parte central......6
6:
-Completamente negra. Gastro cubierto con una pubescencia densa y pelos amarillos más largos......
Camponotus vagus
-Mesosoma total o parcialmente rojizo......7
7:
-Gastro de color negro o con una pequeña mancha rojiza en la base, mate con pubescencia abundante y con escultura superficial. Mesosoma rojo mate. Camponotus herculeanus
-Gastro con pubescencia dispersa, brillante. Parte basal del primer tergito gastral de amarillo rojizo a rojo oscuro. Mesosoma de color rojo pálido......
Camponotus ligniperdus
8:
-Impresión metanotal muy suave, de modo que en vista dosal no se aprecia un salto claro entre meso y metanoto. Cuerpo totalmente negro oscuro......
Camponotus gestroi
-Impresión metanotal muy marcada, de modo que en vista dosal se aprecia un salto claro entre meso y metanoto. Cuerpo negro o bicoloreado......9
9:
-Cabeza y promesonoto rojizo. Propodeo formando un ángulo......
Camponotus lateralis.
-Cabeza y promesonoto rojizo. Propodeo redondeado. Baleares y alguna localidad costera peninsular......
Camponotus ruber.
-Cabeza del mismo color que el gastro......10
10:
-Protorax amarillo rojizo. Resto del cuerpo negro......
Camponotus figaro
-Cuerpo completamente negro......
Camponotus piceus
11:
-Superficies extensoras de las tibias y fémures con pubescencia y pelos erectos. Se encuentra en los nidos de C. aethiops y C. pilicornis......
Camponotus universitatis.
-Superficies extensoras de las tibias y fémures sin pubescencia ni pelos erectos......12
12:
-Depresión mesoporpodeal (entre propodeo y promesonoto) muy marcada. 13
-Perfil del mesosoma simple, sin rupturas. 14
13:
-Microescultura en todo el cuerpo, lo que le da un aspecto totalmente mate......
Camponotus amaurus
-Aspecto brillante. Camponotus foreli
14:
-Márgenes de la gena y pronoto con numerosos pelos Este carácter se observa mejor en obreras
pequeñas......15
-Márgenes de la gena y pronoto sin pelos o con muy pocos. Camponotus sylvaticus.
15:
-Color uniforme marrón oscuro o negro. Camponotus aethiops.
-Mesosoma rojizo o anaranjado......16
16:
-Tibia trasera con un surco longitudinal muy marcado. Camponotus barbaricus
-Tibia trasera sin surco longitudinal o muy poco marcado. Pelos escasos o ausentes en la parte anterior del propodeo......
Camponotus pilicornis
17:
-Propodeo y mitad delantera del gastro de color naranja-amarillento. Tibia trasera acanalada......
Camponotus cruentatus.
-Completamente negra. Tibia trasera sin acanalar......18
18:
-Depresión mesopropodeal marcada en las obreras minor, menos marcada en las major. Pubescencia diluta en el gastro......
Camponotus haroi
-Depresión mesopropodeal no marcada en las minor. Pubescencia abundante en el gastro......
Camponotus micans.
A continuación muestro tres imágenes de una hormiga que aparenta ser del género Camponotus
Camponotus, posiblemente Camponotus amaurus (Espadaler, 1997)
Camponotus amaurus (Espadaler, 1997), subgénero Tanaemyrme
- Cuerpo con un sólo segmento aislado (peciolo) entre el mesosoma y el gastro
- Gastro sin estrangulamiento entre los segmentos primero y segundo. Sin aguijón
- Hendidura cloacal circular, con bordes convexos y peludos (acidoporo). En vista dorsal se aprecian cinco segmentos abdominales en las hembras (6 en los machos).
- El clípeo no seextiende más allá de los lóbulos frontales. Las pupas se encierran en capullos en la mayoríade los géneros.
- Fosas antenales alejadas del margen posterior del clípeo
- Aristas frontales en forma de "S". Sin casta especializada, cabeza no truncada
- Sutura mesopropodeal difusa, de modo que propodeo y mesonoto forman una línea continuavistos de perfil.
- Clipeo provisto de una arista media claramente distinguible, Además de un lóbulo mediomás o menos rectangular. Mandíbulas de 5 o 6 dientes. Propodeo estrecho, más o menoscomprimido.
- Gastro brillante. Cuerpo poco peludo, brillante, al menos sobre el torax
- Superficies extensoras de las tibias y fémures sin pubescencia ni pelos erectos
- Depresión mesoporpodeal (entre propodeo y promesonoto) muy marcada
- Microescultura en todo el cuerpo, lo que le da un aspecto totalmente mate
Camponotus, posiblemente Camponotus amaurus (Espadaler, 1997)
Camponotus, posiblemente Camponotus amaurus (Espadaler, 1997)
Fuentes:
2) Wikipedia